
过继性细胞治疗起源于50年代,时至今日,已发生了翻天覆地的变化。现在,该疗法进入嵌和抗原受体改造阶段,主要的技术为CAR-T/NK疗法,其优点是可将肿瘤的识别与激活集中在效应细胞,且不受MHC分子限制,能极大提高效应细胞激活与杀瘤效率。在已有的一些案例中也能看到细胞治疗产品在疗效上有着巨大优势,尤其是在血液瘤领域。
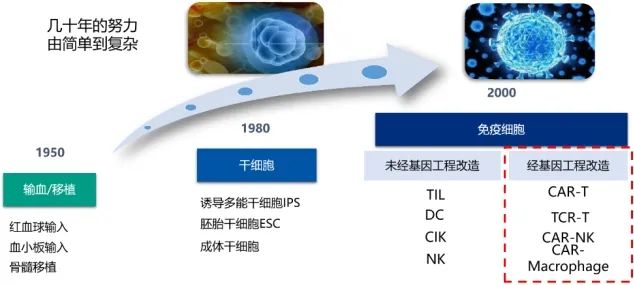
不过,尽管细胞治疗产品已取得了在科学上的巨大成功,在商业前景上却还面临着困局。抛开细胞疗法各自本身一些疗效弊端之外,最大的受阻因素还是耗资巨大。

细胞治疗高成本的内在因素 目前,多数的细胞治疗产品都是来自患者本身的细胞,因此对整个体系的闭环化管理和冷链控制都提出非常高的要求,而自体细胞产品无法通过规模化生产来平摊成本。 另一方面,对于细胞治疗产品而言,经过上市审批的一系列流程之后,对于物料、工艺的更改优化其实可操控空间非常小,因为这些变更优化都会涉及对产品属性产生影响。而国内很多此类产品的生产检定体系都是依托于先前的实验室的体系,对整个GMP体系的搭建上,也没有办法做到成本优化。 这样看来,在细胞产品的工艺上现在还没有节流之地,那么为推动其商业化有没有其它可以努力的方向? 我们认为:首先,不能局限在血液瘤的市场里,应尽量去发现并利用新的靶点,推动新的适应症,例如实体瘤;其次,实现“异体应用”,缩短患者等待疗法的时间。

细胞治疗成本和创新的机遇与挑战pg电子
01 NK细胞有治疗实体瘤和异体应用潜力
当然,用细胞产品治疗实体瘤并非易事,需要克服靶点选择,浸润障碍,体内持续性,激活有效性和抑制性肿瘤微环境等困难。而要达到这样的性能,就意味着我们要对细胞做更精细和更复杂的基因工程改造,但现有的技术尚不能满足这样的工程学要求,如LVV/RVV包装容量有限,转座子的转座酶效率不够高等。

传统基因工具的局限性 尽管有些令人沮丧,不过好在似乎还有其他路线可以去实现:
●Allogene的CAR-T细胞 ,采用健康供体或者脐带血作为细胞来源,并对其进行基因工程改造和基因编辑,敲除TCR等基因,以防止免疫排斥反应。不过,要推进该路线前进需考虑到宿主和供体间的排斥反应、体外生产规模能做到多大、转基因操作的均一性和效率等问题。 目前来看,采用该路线单批次的产能顶多达到100个Dose,这对于理想状态下的货架产品来说,还远远不足。另外,使用健康供体的T细胞为原材料,会出现做多次复杂的转基因操作,再经过大量扩增后,基因组的稳定性差等问题。
●另外一条路线是以Dan Kaufmann在2013年发表的一篇研究为代表:用IPS细胞作为源材料,经过基因工程操作,让IPS带上CAR分子,再经过诱导分化,变成CAR-T细胞。 但这种方法在细胞分化过程中,绕不开Notch Pathway。如果要提供Notch通路的激活信号,就必须用到滋养层细胞,使造血干细胞能够分化成T细胞。此外,如果开发一个产品需使用鼠源细胞作为滋养层的话,将面临着不论后期如何去除鼠源细胞,还是有可能会出现带入鼠源DNA等外源抗原性物质的合规性风险。鼠源永生化滋养层细胞存在严重的合规性问题
分析至此,可以发现以上路线都存在不同的潜在风险,那是否还有其他选择?
●在对现有技术进行综合评估后,我们认为NK细胞可作为首选。NK细胞不同于T细胞需要通过TCR去识别恶变细胞,而是通过KAR/KIR系统来识别,因此不会引起GvHD。 另一方面,目前的抗体药物大多是通过增强或刺激NK细胞的ADCC效应来实现肿瘤杀伤,NK细胞也更容易和已有的抗体药物,或其他药物进行联用。 此外,NK细胞和T细胞同属淋巴细胞系,CAR分子使用的激活元件和通路,NK细胞也有表达。将CAR装载在NK细胞上也能起到很好的肿瘤细胞靶向杀伤作用。

NK细胞有治疗实体瘤和异体应用潜力 基于NK细胞的特性,再结合iPSC的潜力,那么iPSC来源的CAR-NK细胞其实是一个潜力股。 在这块领域的相关研究上,Fate公司是先行者: 2021年夏天,Fate公布了候选产品FT516的早期临床结果,结果显示,iPSC来源的NK细胞和天然的NK细胞一样,能够有效的杀伤肿瘤细胞。而另一款FT596(CD19 CAR-NK细胞)的数据显示,其疗效不弱于自体的CD19 CAR-T产品。

Fate最新临床报道
02 来源多样化的NK细胞路线及利弊
在解决细胞治疗实体瘤的问题上,我们已经有了一个方向:NK细胞可作为首选。但若想推动细胞产品的商业化,这还不够。我们还需要考虑:如何做成现货细胞,使其能规模化生产?在回答这个问题之前,需要明白:NK细胞有不同的来源,对规模化生产的要求也就不同。所以,我们先对NK细胞的来源路线做个分析:
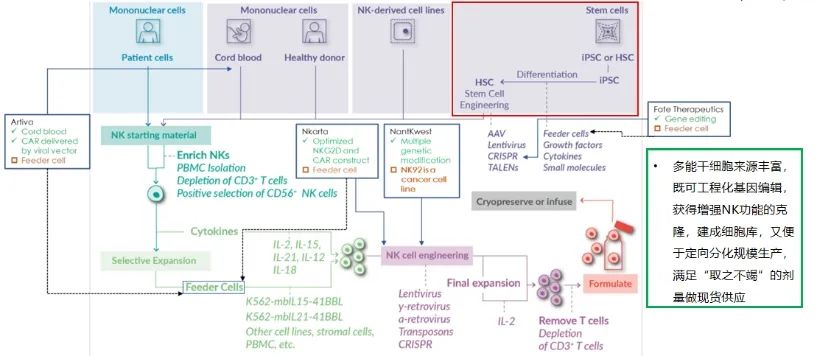
来源多样化的NK细胞技术路线及利弊
●第一种:从患者自身外周血出发,然后扩增,改造,回输。 但这个路线和自体CAR-T面临一样的问题和挑战,就是患者的细胞能制备出什么样的细胞,完全是一个不受控的事情。
●第二种:将脐带血或健康供体的细胞作为起始原材料进行制备。 这个路线,以美国MD安德森为例。2020年,美国MD安德森和Takeda公司公布了一个1期临床数据,数据显示具有很好的效果,且可以从一份脐血中生产出50个Dose的终产品。但由于原材料的有限性,整个生产制备过程中没有办法实现均一化、克隆化,以及对细胞产物的密切追踪。因此该路线不见得是最优的路线。
●第三种:使用NK92之类的永生化细胞系开发产品。 虽然这样可以优化产品的均一性,但其作为一种永生化细胞,要制备成一个治疗产品,一定要在收获之前对它进行无害化处理,即用毒素/辐射等方式使其失去扩增能力。 但经过这样处理的细胞,进入体内后它的肿瘤杀伤能力和持久性会大大下降。同时,因为是从永生化细胞起源,这种技术路线出来的产品难免会有染色体的异质性,存在一定风险。
●最后一种:以iPSC为起始原细胞的技术路线。 由于我们要做到更优的效果,那么对细胞的改造一定是复杂的,而对于iPSC这样的永生细胞来说,进行再复杂的改造,也可以对其进行单克隆,并进行详尽的表征研究,挑选出最优的克隆用于后续的生产。 研究分子或者CAR的插入位点、表达水平、copy number,以及细胞最后核型与整个基因型是否正常,全基因组测序以后是否能保持稳定。经过完整的研究的细胞株单克隆,就可以作为起始点的一个生产细胞库。再经过一步一步诱导、分化、扩增,最后变成我们需要的产品。
不过,对于该技术,有两个不得不关注的重点: 第一,基因编辑。编辑什么样的基因,转什么样的元件,放在IPS基因组的哪一个位点,起什么样的作用? 第二,如何多快好省,又稳定地把NK细胞分化出来pg电子官网地址?若能建立相应的平台,那么针对不同的适应症、不同的靶点,我们只需要做相应的CAR分子替换,就能实现整个Pipeline的快速迭代。
对此,分享下星奕昂对该工艺开发的突破重点: ① 利用iPSC细胞可以形成类似embryo body的特性,在悬浮体系中利用全封闭/自动化的生物反应器完成iPSC到HSC的细胞命运分化; ② 使用3D微载体,结合GMP级别的细胞因子,代替传统的K562滋养细胞,在生物反应器中完成HSC到NK细胞的分化扩增; ③ 开发适用于大规模制备的细胞药物的内包材和自动灌装系统。
结语
结合上述内容,我们认为iPSC-CAR-NK 非常有潜力成为异体通用型现货细胞治疗实体瘤的药物。当然,该技术的开发还属于早期,犹如冰山一角,有许多想法还需进一步优化和验证。希望能与中国生物医药界,以及生物科技界的同仁一起,在这个领域里有所创新、有所突破。
来源丨生物前哨
作者丨Dara
编辑丨Dara
